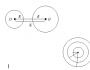
Определить скорость осаждения частиц. Схемы процесса отстаивания
Осаждение - это процесс разделения жидких или газовых неоднородных систем, при котором взвешенные в жидкости или газе твердые или жидкие частицы отделяются от сплошной фазы под действием силы тяжести, сил инерции (в том числе центробежных) или электростатических сил.
Осаждение, происходящее под действием силы тяжести, называется отстаиванием. В основное отстаивание применяется для предварительного, грубого разделения неоднородных систем.
Основной характеристикой рассматриваемого процесса разделения суспензий и газовзвесей является скорость осаждения, т.е. скорость относительного движения твердых частиц. При определении этой скорости необходимо различать свободное и стесненное осаждение. Свободное осаждение, наблюдающееся в разбавленных суспензиях и газовзвесях, характеризуется отсутствием взаимного влияния частиц дисперсной фазы, т.е. каждая из них ведет себя как одиночная частица в окружающей сплошной среде.
С ростом концентрации твердой фазы, благодаря взаимному влиянию пограничных слоев и столкновения соседних твердых частиц, осаждение становится стесненным, сопротивление частиц потоку возрастает и скорость их движения падает.
Рассмотрим прямолинейное равномерное движение
частицы, подчиняющееся закону Ньютона. При движении
частица встречает сопротивление среды, которое может
быть определено
где S ч - проекция поперечного сечения частицы на
направление ее движения, м 2 ; р 0 - плотность среды, кг/м 3 ;
w ч - скорость частицы, м/с; ς ч - аэродинамический
коэффициент сопротивления частицы. Коэффициент сопротивления частицы ς ч зависит от числа Рейнольдса Re v . Для шаровой частицы
![]()
здесь μ 0 - динамическая вязкость воздуха (газа), Па-с; d ч, -диаметр частицы, м.
![]()
Эта формула выражает закон Стокса: сила сопротивления, испытываемая твердым шаровым телом при медленном движении в неограниченной вязкой среде, прямо пропорциональна скорости поступательного движения, диаметру тела и вязкости среды.
Закон Стокса применим при ламинарном движении частиц, когда Re ч <2. Область применения закона Стокса практически - определяется размерами частиц и требуемой точностью: при 16·10 -4 < d ч < 30·10 -4 см, неточность составляет 1 %; при 1,6·10-4 < d ч <70·10 -4 см - 10 %. Если допустима большая неточность, можно распространить формулу на область 10 -5 Для точных вычислений в закон Стокса вводится поправка Кенингема С к для частиц размером 0,2-2,0 мкм: Пылевые частицы малых размеров участвуют в броуновском движении - беспорядочном хаотическом перемещении частиц под действием ударов молекул. Чем меньше размер частицы, тем большую роль в ее перемещении играет броуновское движение. Скорость осаждения и величина броуновского смещения соизмеримы для частиц, начиная примерно с 0,5 мкм. С уменьшением размера частиц скорость осаждения резко снижается и возрастает броуновское смещение. Для частиц размером 0,05...0,02 мкм оно уже на два - три порядка превышает путь частицы при свободном падении. Поэтому высокодисперсные аэрозольные частицы практически не осаждаются, а благодаря броуновскому движению перемещаются в любом направлении. Если рассматривается движение нешарообразной частицы, в расчетных формулах значение ς ч умножается на динамический коэффициент формы z вместо d ч вводят эквивалентный диаметр: z=d э 3 /d ч 3 где d э - эквивалентный диаметр частицы, равный диаметру шара, объем которого равен объему данной частицы, м. В движении частицы, осаждающейся под действием силы тяжести в неподвижной среде, можно различить три стадии: начальной момент падения; движение с увеличением скорости до того момента, пока силы сопротивления и силы тяжести не уравновесятся; равномерное движение с постоянной скоростью. Первые две стадии имеют малую продолжительность. Осаждение применяется для грубого разделения суспензий под действием сил тяжести. Этот процесс проводится в аппаратах, называемых отстойниками. Для расчета отстойников необходимо рассчитать скорость осаждения, т.е. скорость движения твердых частиц в жидкости. Для вывода формул расчета скорости осаждения рассмотрим движение твердой частицы шарообразной формы в неподвижной жидкости под действием сил тяжести. Если частица осаждается под действием сил тяжести, то скорость ее движения в жидкости сначала возрастает из-за ускорения свободного падения. Одновременно с увеличением скорости частицы будет расти сопротивление среды ее движению, поэтому ускорение частицы будет уменьшаться и через некоторое время станет равным нулю. При этом наступает равновесие действующих на частицу сил, и она будет двигаться равномерно с постоянной скоростью, которая и является скоростью осаждения. Рассмотрим силы, действующие на осаждающуюся частицу в жидкости (рисунок 4.3). По второму закону Ньютона Рисунок 4.3 – Силы, действующие на частицу при ее движении в вязкой среде: – сила тяжести; – сила Архимеда (подъемная); – сила сопротивления среды; Мы рассматриваем мелкие частицы. Они очень быстро начинают двигаться равномерно с постоянной скоростью. Поэтому можно принять, что , т.е. разгона частиц почти нет или им пренебрегают ( где – диаметр частицы; индекс « » – частица, « » – жидкость. где (дзета) – коэффициент сопротивления; – динамический напор или кинетическая энергия омывания единицы объема; – проекция частицы на плоскость, перпендикулярную направлению ее движения. Т.к. частица – шар, то – площадь ее поперечного сечения. Определение скорости осаждения. Подставим выражения (4.7) и (4.8) в (4.4) Для того, чтобы рассчитать по формуле (4.11) скорость осаждения необходимо знать величину . Коэффициент сопротивления зависит от режима обтекания частицы жидкостью. В логарифмических координатах зависимость от имеет вид, представленный на рисунке 4.4. Расчет скорости по уравнению (4.11) проводят только методом последовательного приближения в следующем порядке: 1. задаются режимом осаждения; 2. подставляют в формулу (4.10) соответствующее режиму выражение вместо ; 3. из полученного уравнения рассчитывают скорость осаждения; 4. по скорости определяют значение критерия Рейнольдса и режим осаждения; 5. если режим получился другой, то заново пересчитывают скорость. Рисунок 4.4 – Вид зависимости коэффициента сопротивления от критерия Рейнольдса для различных режимов осаждения частицы (в логарифмических координатах). Рассмотренный выше метод расчета скорости осаждения не очень удобен и длителен. Поэтому для удобства использования в расчетной практике Лященко предложил другой метод. По этому методу скорость выражается из критерия Рейнольдса, возводится в квадрат и подставляется в уравнении (4.10) ( Примем за критерий Архимеда выражение Физический смысл критерия Архимеда заключается в том, что он учитывает соотношение сил тяжести, вязкости и силы Архимеда. Получим критериальное уравнение для расчета скорости осаждения: Порядок расчета скорости
осаждения по методу Лященко. 1. Рассчитываем значение критерия Архимеда по выражению (4.14). 2. По определяем режим осаждения и выбираем формулу для расчета коэффициента сопротивления . Это возможно, так как согласно критериальному уравнению (4.15) между и есть однозначное соответствие. Но критерий Архимеда, в отличие от , не зависит от скорости осаждения, а определяется только геометрическими размерами частицы и свойствами материала частицы жидкой среды. Ламинарный режим движения При ламинарном движении, наблюдающемся при небольших скоростях и малых размерах тел или при высокой вязкости среды, тело окружено пограничным слоем жидкости и плавно обтекается потоком (рисунок 4.5 ). Потеря энергии в таких условиях связана в основном лишь с преодолением сопротивления трения. Критерий Рейнольдса . Рисунок 4.5 – Движение частицы в жидкой среде при различных режимах: ламинарном (), переходном () и турбулентном (). Для ламинарного
Таким образом, если < 2, то < 36 - ламинарный режим осаждения (обтекания частицы). Переходный режим движения С увеличением скорости движения тела все большую роль начинают играть силы инерции. Под действием этих сил пограничный слой отрывается от поверхности тела, что приводит к понижению давления за движущимся телом в непосредственной близости от него и к образованию беспорядочных местных завихрений в данном пространстве (рисунок 4.5 ). При этом разность давлений жидкости на переднюю (лобовую) поверхность тела, встречающую обтекающий поток, и на его заднюю (кормовую) поверхность все больше превышает разность давлений, возникающую при ламинарном обтекании тела. Для переходного
режима осаждения , подставим в выражение (4.15) Твердая частичка или жидкая капелька, движущаяся под действием силы тяжести сквозь вязкую жидкость, в конечном счете приобретает постоянную скорость. Она называется скоростью осаждения. Если плотность частицы ниже, чем плотность жидкости, она будет двигаться вверх со скоростью всплытия. Эти скорости обозначаются буквами vg (g – сила тяжести). Величина скорости осаждения/всплытия определяется следующими физическими параметрами: диаметром частицы d, м плотностью частицы ρp, кг/м3 плотностью непрерывной фазы, ρl, кг/м3 вязкостью непрерывной фазы η, кг/м,с ускорением силы тяжести g = 9,81 м/с2. Если известны значения всех вышеперечисленных параметров, то можно рассчитать скорость осаждения/всплытия частицы или капли при помощи следующей формулы, выведенной из закона Стокса (формула 1): Подставляем эти значения в формулу получим: Как видим из полученного результата, жировые шарики поднимаются очень медленно. На практике шарики жира образуют крупные скопления и их всплытие происходит гораздо быстрее. Периодическое сепарирование под действием силы тяжести
Рисунок 1
В сосуде А, показанном на рис. 1, содержится жидкость, в которой во взвешенном состоянии находятся твердые частицы одинаковых размеров и более плотные, чем жидкость. Для того чтобы находящиеся на поверхности жидкости частицы опустились на дно, должно пройти довольно много времени. Время осаждения может быть сокращено при условии сокращения этой дистанции. Высоту сосуда (В) уменьшили, а площадь увеличили с тем, чтобы объем остался неизменным. Дистанция осаждения (h2) уменьшилась до 1/5 от первого варианта (h), и время, требуемое для полного разделения фракций, так же сократилось до 1\5 (рисунок 2). Рисунок 2
Непрерывное сепарирование под действием силы тяжести
Простейший сосуд, в котором может осуществляться непрерывное отделение частичек разного диаметра от жидкости, показан на рис. 3. Жидкость, содержащая частички в виде шлама, поступает в сосуд с одного его конца и движется в направлении выхода на другом конце под определенным напором. При движении частички оседают с различной скоростью в зависимости от их диаметров. Рисунок 3
При непрерывном отделении взвеси от жидкости в сосуде с горизонтальными экранами осадительные каналы будут постоянно забиваться собирающимися в них частицами. В конце концов процесс остановится. В сосуде с наклонными экранами, показанном на рис. 4, частицы, оседающие на экранах, соскальзывают под действием силы тяжести с экранов и скапливаются на дне сосуда. Рисунок 4
Почему частицы, оседающие на экранах, не захватываются жидкостью, текущей вверх между экранами? Объяснение дано на рис. 5, на котором показан разрез части осадительного канала. Когда жидкость течет между экранами, ее пограничный слой, ближайший к экранам, тормозится трением, и поэтому скорость его падает до нуля. Стационарный пограничный слой оказывает тормозящее воздействие на соседний слой, и так далее в направлении к центру канала, где скорость максимальная. Рисунок 5
Получается профиль скоростей, как показано на рисунке 5, – ламинарный поток в канале. Частицы, осевшие в стационарной пограничной зоне, таким образом, находятся под воздействием только силы тяжести. Поверхность для осаждения, используемая при прохождении через сосуд с наклонными вставками максимального потока, должна быть предварительно рассчитана. Для полного использования пропускной способности разделительного сосуда необходимо предоставить оседающим частицам как можно большую поверхность. Расстояние, в пределах которого происходит осаждение, не оказывает непосредственного влияния на пропускную способность сосуда, но какую-то минимальную ширину канала необходимо выдерживать, чтобы не допустить забивания каналов оседающими частицами. Характерным общим
свойством суспензий, порошков, эмульсий
и аэрозолей, особенно если они разбавлены,
являетсц склонность к оседанию или
всплыванию частиц дисперсной фазы.
Оседание частиц дисперсной фазы
называется седиментацаей, а всплывание
частиц - обратной седиментацией. На каждую частицу
в системе действует сила тяжести
(гравитационная сила) и подъемная сила
Архимеда: Эти силы постоянны
и направлены в разные стороны,
равнодействующая сила, вызывающая
седиментацию, равна: Так как седиментация
протекает в определенной среде, то при
ламинарном движении частицы возникает
сопротивление - сила трения,
пропорциональная скорости движения
частнцы: Таким образом,
сила, действующая на частицу, во время
движения, равна: C
ростом скорости при достаточно большом
коэффициенте трения наступает момент,
когда сила трения достигает силы,
вызывающей седиментацию, и таким образом
движущая сила F
оказывается равной нулю. Выражение для силы
трения, возникающей при движении
сферических частиц, можно представить
в виде закона Стокса: . Подставляя ее в
полученное уравнение и выражая объем
частицы через ее радиус, получим: 1) Закон Стокса
справедлив, если частицы дисперсной
фазы осаждаются независимо друг от
дpyra,
что может быть только в разбавленных
системах. 2) Обычно частицы
в дисперсных системах и твердой дисперсной
фазой имеют неправильную форму. При
свободном оседании частица несферической
формы ориентируется в направлении
движения таким образом, чтобы создавалось
максимальное сопротивление движению,
что уменьшает скорость осаждения. 3) Закон Стокса
может не соблюдаться и при турбулентном
режиме осаждения частиц. 4) Закон Стокса
предполагает наличие внутреннего
трения, или вязкого трения, когда граница
(поверхность) движения частицы относительно
среды находится внутри дисперсионной
среды, вязкость которой определяет
коэффициент трения. Если межфазное
взаимодействие мало, граница (поверхность)
движения частицы относительно среды
может совпадать с поверхностью раздела
фаз и трение оказывается внешним. Это
приводит к возникновению скольжения,
ускоряющему движение частицы. 5) Применимость
закона Стокса ограничивается также
дисперсностью частиц. Большие частицы
(>100 мкм) могут двигаться ускоренно,
очень малые частицы - ультрамикрпгетерогенные
(<0,1 мкм) осаждаются настолько медленно,
что следить за такой седиментацией
практически невозможно. Принцип
седиментационного метода анализа
дисперсности состоит в измерении
скорости осаждения частиц, обычно в
жидкой среде. По скорости осаждения с
помощью соответствующих уравнений
рассчитывают размеры частиц. Метод
позволяет определить распределение
частиц по размерам и соответственно
подсчитать их удельную поверхность. П Имеются графические
и аналитические методы расчета кривой
седиментации. Р Результаты
седиментациоиного анализа дисперсности
полиднсперсных систем представляют
также в виде кривых распределения частиц
по размерам, характеризующих степень
полиднсперсности системы. Кривая распределения
является наглядной и удобной характеристикой
полидисперсности системы, по которой
легко определить содержание различных
фракций. Ее строят подобно кривой
распределения пор по размерам. Обычно
сначала получают интегральную кривую
распределения, проводят ее выравнивание
с учетом точности получаемых средних
значений радиусов частиц фракций и
затем по ней строят дифференциальную
кривую распределения. Иногда
дифференциальную кривую строят сразу.
На оси абсцисс откладывают значения
радиусов; на ось ординат наносят отношение
приращения массовых долей к разности
радиусов частиц соседних фракций Δx/Δr i .
Построив на графике отдельные
прямоугольники для каждой фракции
(гистограмму) и соединив плавной кривой
середины их верхних сторон, получают
дифференциальную кривую распределения
частиц полидисперсной системы по
размерам. Используя
уравнение Эйнштейна, рассчитайте
вязкость золя AgC
l
,
имеющего концентрацию 10% массовых и
содержащего сферические частицы.
Плотность AgC
l
:
5,56·10
3
кг\м
3
;
вязкость и плотность дисперсионной
среды составляют 1·10
-3
Па·с и 1000 кг/м
3
соответственно.
Экзаменационный
билет № 6
Влияние
дисперсности на термодинамическую
реакционную способность. Вывод уравнения
капиллярной конденсации Кельвина.
Влияние дисперсности на растворимость,
константу равновесия химической реакции
и температуру фазового перехода.
Термодинамическая
реакционная способность характеризует
способность вещества переходить в
какое-либо иное состояние, например
переходить в другую фазу, вступать в
химическую реакцию. Она указывает на
удаленность данного состояния вешества
или системы компонентов от равновесного
состояния при определенных условиях.
Термодинамическая реакционная способность
определяется химическим сродством,
которое можно выразить изменением
энергии Гиббса или разностью химических
потенциалов. Реакционная
способность зависит от степени
дисперсности вещества, изменение которой
может приводить к сдвигу фазового или
химического равновесия. Соответствующее
приращение энергии Гиббса dG д
(благодаря изменению дисперсности)
можно представить в виде объединенного
уравнения первого и второго начал
термодинамики: Для индивидуального
вещества V=V м
и при Т=const
имеем: Подставляя в это
уравнение соотношение Лапласа, получим: для сферической
кривизны: Если рассматривается
переход вещества из конденсированной
фазы в газообразную, то энергию Гиббса
можно выразить через давление пара,
приняв его за идеальный. Дополнительное
изменение энергии Гиббса, связанное с
изменением дисперсности, составляет: Подставляя данное
выражение, получим: Полученное
соотношение называется уравнением
Кельвина (уравнение капиллярной
конденсации). Для неэлектролитов
его можно записать следующим образом: Из этого уравнения
видно, что с увеличением дисперсности
растворимость растет, или химический
потенциал частиц дисперсной системы
больше, чем у крупной частицы, на величину
2σV/r. Степень дисперсности
может влиять также на равновесие
химической реакции: С увеличением
дисперсности повышается активность
компонентов, а в соответствии с этим
изменяется константа химического
равновесия в ту или другую сторону, в
зависимости от степени дисперсности
исходных веществ и продуктов реакции. С изменением
дисперсности веществ изменяется
температура фазового перехода. Количественная
взаимосвязь между температурой фазового
перехода и дисперсностью вытекает из
термодинамических соотношений. Для фазового
перехода:, Для сферических
частиц: Видно, что с
уменьшением размера частиц г температуры
плавления и испарения вещества уменьшаются
(H ф.п. >0). Природа
броуновского движения. Понятие и
определение среднеквадратичного сдвига
по выбранному направлению. Взаимосвязь
между среднеквадратичным сдвигом и
коэффициентом диффузии (ввод уравнения
Эйнштейна-Смолуховского).
Основой доказательства
теплового молекулярного движения в
телах явилось обнаруженное английским
ботаником Робертом Броуном в 1827 г. с
помощью микроскопа непрерывное движете
очень мелких частичек - спор папоротника
(цветочной пыльцы), взвешенных в воде.
Более крупные частицы находились в
состоянии постоянного колебания около
положения равновесия. Колебания и
перемещения частиц ускорялись с
уменьшением их размера и повышением
температуры и не были связаны с какими-либо
внешними механическими воздействиями. Теоретически
обоснованная интерпретация броуновского
движения - участие частиц дисперсной
фазы ультрамикрогетерогенных систем
в тепловом движении - была дана независимо
друг от друга Эйнштейнии (1905 г.) и
Смолуховским (1906 г.). Проведенными
исследованиями была окончательно
доказана природа броуновского движения.
Молекулы среды (жидкости или газа)
сталкиваются с частицей дисперсной
фазы, в результате чего она получает
огромное число ударов со всех сторон. Э Под микроскопам
наблюдают проекцию смещения частицы
на плоскость за какое-то время, поэтому
. При равновероятных
отклонениях частицы ее направление
будет находиться между направлениями
x
и у, т. е. под углом 45° к каждой координате.
Отсюда или Из-за равновероятных
отклонений среднеарифметическое
значение сдвигов равно нулю. Поэтому
используются среднеквадратичные
расстояния, проходимые частицей: Эйнштейн и
Смолуховский, постулируя единство
природы броуновского движения и теплового
движения, установили количественную
связь между средним сдвигом частицы
(называемым иногда амплитудой смещения)
и коэффициентом диффузии D. Если броуновское
движение является следствием теплового
движения молекул среды, то можно говорить
о тепловом движении частиц дисперсной
фазы. Это означает, что дисперсная фаза,
представляющая собой совокупность
числа частиц, должна подчиняться тем
же статистическим законам
молекулярно-кинетической теории,
приложимым к газам или растворам. Д Так как |Q 1 |
> |Q 2 |
(ν 1 >ν 2),
то суммарное количество перенесенного
вещества через плоскость MN
вправо определится соотношением . Градиент концентрации
по расстоянию в направлении диффузии
можно выразить так: Подставляя, получим:
Сравнивая это
соотношение с первым законом диффузии
Фика: Это уравнение
выражает закон Эйнштейна - Смолуховского,
в соответствии с которым квадрат среднего
сдвига пропорционален коэффициенту
диффузии н времени. Для
отрицательно заряженного гидрозоля
A
l
2
S
3
,
порог коагуляции при добавленном КС
l
равен 49 ммоль/л. Используя закон Дерягина,
рассчитайте пороги коагуляции для таких
электролитов как Na
2
S
O
4
,
MgC
l
2
и A
l
C
l
3
.
Экзаменационный
билет № 7
Методы
получения дисперсных систем: диспергирование
и конденсация. Уравнение Ребиндера для
работы диспергирования. Адсорбционное
понижение прочности (эффект Ребиндера).
Конденсация физическая и химическая.
Энергия Гиббса образования зародыша
новой фазы при гомогенной конденсации;
роль пересыщения.
Диспергирование
и конденсация - методы получения
свободно-дисперсных систем: порошков,
суспензий, золей, в том числе аэрозолей,
эмульсий и т. д. Под диспергированием
понимают дробление и измельчение
вещества, под конденсацией - образование
гетерогенной дисперсной системы из
гомогенной в результате ассоциации
молекул, атомов или ионов в агрегаты. Работа упругого
и пластического деформирования
пропорциональна объему тела: Работа образования
новой поверхности при диспергировании
пропорциональна приращению поверхности:
Полная работа,
затрачиваемая на диспергирование,
выражается уравнением Ребиндера: Разрушение
материалов может быть облегчено при
использовании эффекта Ребиндера -
адсорбционного понижения прочности
твердых тел. Этот эффект заключается в
уменьшении поверхностной энергии с
помощью поверхностно-активных веществ,
в результате чего облегчается
деформирование и разрушение твердого
тела. Процесс конденсации
предполагает образование новой фазы
на уже имеющихся поверхностях (стенках
сосуда, частицах посторонних веществ
- ядрах конденсации) или на поверхности
зародышей, возникающих самопроизвольно
в результате флуктуации плотности и
концентраций вещества в системе. В
первом случае конденсация называется
гетерогенной, во втором - гомогенной. Чтобы сконденсированное
вещество не возвращалось в первоначальную
фазу и конденсация продолжалась, исходная
система должна быть пересыщенной. В
противном случае конденсация не может
происходить, исчезают и зародыши
конденсации (путем их испарения,
растворения, плавления). При гомогенной
конденсации происходит самопроизвольное
образование зародышей; энергия поверхности
выступает в качестве потенциального
барьера конденсации. Энергию Гиббса
образования зародышей выражают (в
соответствии с объединенным уравнением
первого и второго начал термодинамики)
в виде четырех составляющих: энтропийной,
механической, поверхностной и химической. Для жидких и
газообразных фаз можно ограничиться
двумя первыми составляющими энергии
Гиббса образования зародышей. Е Если степень
пересыщения больше критической величины,
то возникающие зародыши будут
самопроизвольно расти. Критическая энергия
Гиббса образования зародышей конденсации
соответствует критической точке -
максимуму функции ΔG
= f(r):
Таким образом,
энергия Гиббса образования зародышей
при гомогенной конденсации равна одной
трети поверхностной энергии зародыша.
Если найти радиус зародыша в критической
точке, приравняв к нулю первую производную
от энергии Гиббса и подставить его в
данное выражение, то получим: Из этого соотношения
следует, что энергия образования зародыша
конденсации зависит от степени
пересыщения, от нее же зависит и размер
критического радиуса зародыша. Чем выше
степень пересыщения, тем ниже энергия
Гиббса образования зародышей и тем
меньше размеры образующихся зародышей,
способных к дальнейшему росту. Методы разделения
гетерогенных систем: осаждение,
фильтрование, центрифугирование, мокрое
разделение.
Осаждение
представляет
собой процесс разделения,
при котором
взвешенные в жидкости или газе твёрдые
и жидкие частицы отделяются от сплошной
фазы под действием силы тяжести,
центробежной
силы, сил
инерции, и
электрических сил. Фильтрование
–
процесс
разделения с помощью пористой перегородки,
способной
пропускать жидкость или газ,
но задерживать взвешенные частицы.
Движущей силой
процесса является разность давлений. Мокрая очистка
газов
–
процесс
улавливания взвешенных в газе частиц
какой-либо
жидкостью,
под действием
сил тяжести или сил инерции и применяется
для очистки газов и разделения суспензий. ЦЕНТРИФУГИРОВАНИЕ
– разделение в поле центробежных сил
жидких дисперсных систем с частицами
размером более 100 нм. Используют для
выделения составляющих фаз (жидкая -
фугат или фильтрат, твердая - осадок)
из двухкомпонентных (суспензии, эмульсии)
и трехкомпонентных (эмульсии, содержащие
твердую фазу) систем. В практике
центрифугирования применяются два
способа разделения жидких неоднородных
систем: центробежное фильтрование и
центробежное осаждение. В первом случае
центрифуги изготовляются с перфорированным
ротором, на внутренней стенке (обечайке)
которого уложена фильтровальная
перегородка - фильтрующие центрифуги,
во втором - с отстойным ротором, имеющим
сплошную обечайку - отстойные центрифуги.
Изготовляются также комбинированные
отстойно-фильтрующие центрифуги, в
которых совмещаются оба принципа
разделения. Скорость ОСАЖДЕНИЯ
зависит от физических свойств дисперсной
и дисперсионной фаз, концентрации
дисперсной фазы, температуры. Скорость
ОСАЖДЕНИЕ
отдельной
сферич. частицы описывается уравением
Стокса: Woc
= /18μc
; где Woc
– ск-ть
свободн.осаждения тв.частицы
шарообразн.формы,
м/с; d –
диаметр
частицы, м;
ρт –
плотность
твёрдой частицы,
кг/м3; ρс
– плотность
среды, кг/м3;
μс –
динамическая
вязкость среды,
Па.с. Уравнение Стокса
применимо лишь к строго ламинарному
режиму движения частицы, когда число
Рейнольдса Re < 1,6, и не учитывает
ортокинетич, коагуляцию, поверхностные
явления, влияние изменения концентрации
твердой фазы, роль стенок сосуда и др.
факторы. Для частиц
неправильной формы скорость осаждения
меньше, и потому скорость, рассчитанную
для шарообразной частицы, необходимо
умножить на поправочный коэффициент
φ, называемый коэффициентом (или
фактором) формы. W
=
φ*W
oc
шар.
где W
– скорость
осаждения твердых частиц произвольной
формы, м/с; φ – коэффициент
формы. Коэффициенты
формы частиц: Кубическая, φ =
0,806; Продолговатая,
φ = 0,58;- круглая, φ = 0,69; Пластинчатая, φ
= 0,43;- угловатая, φ = 0,66; Флотацию применяют
для удаления из сточных вод нерастворимых
диспергированных примесей, которые
самопроизвольно плохо отстаиваются.
В некоторых случаях флотацию используют
и для удаления растворимых веществ
(например, ПАВ). Различают следующие
способы флотационной обработки сточных
вод: С выделением
воздуха из растворов; С механическим
диспергированием воздуха; С подачей воздуха
через пористые материалы; Электрофлотация; Химическая
флотация. Флотацию с
выделением воздуха из растворов
применяют для очистки сточных вод,
которые содержат очень мелкие частицы
загрязнений. Сущность способа заключается
в создании пересыщенного раствора
воздуха в сточной жидкости. При уменьшении
давления из раствора выделяется пузырьки
воздуха, которые флотируют загрязнение. В зависимости от
способа создания пересыщенного раствора
воздуха в воде различают:
- вакуумную; - напорную; - эрлифтную
флотацию. При вакуумной
флотации сточную воду предварительно
насыщают воздухом при атмосферном
давлении в аэрационной камере, а затем
направляют во флотационную камеру, где
вакуум-насосом поддерживается разряжение
30 – 40 кПа. Выделившиеся в камере
мельчайшие пузырьки выносят часть
загрязнений. Процесс флотации длится
около 20 минут. Достоинствами
этого способа являются: Образование
пузырьков газа и их слипание с частицами,
происходящие в спокойной среде; Затраты энергии
на процесс минимальны. Недостатки: Незначительная
степень насыщения стоков пузырьками
газов, поэтому этот способ нельзя
применять при высоких концентрациях
взвеси частиц, не больше 250 – 300 мг/л); Необходимость
сооружать герметично закрытые флотаторы
и размещать в них скребковые механизмы. Напорные установки
имеют большее распространение, чем
вакуумные, они просты и надежны в
эксплуатации. Напорная флотация
позволяет очищать сточные воды с
концентрацией взвесей до – 5 г/л. Для
увеличения степени очистки в воду
иногда добавляют коагулянты. Процесс осуществляется
в две стадии: 1) насыщение воды
воздухом под давлением; 2) выделение
растворенного газа под атмосферным
давлением. Механическое
диспергирование воздуха во флотационных
установках обеспечивается турбинками
насосного типа – импеллерами, которые
представляют собой диск с обращенными
вверх лопатками. Такие установки широко
используют для очистки сточных вод с
высоким содержанием взвешенных частиц
(более 2 г/л). При вращении импеллера в
жидкости возникает большое число мелких
вихревых потоков, которые разбиваются
на пузырьки определенной величины.
Степень измельчения и эффективность
очистки зависит от скорости вращения
импеллера: чем больше скорость, тем
меньше пузырек и тем больше эффективность
процесса. основан на процессе
обмена межу ионами,
находящимися
в растворе, и
ионами,
присутствующими
на поверхности твердой фазы –
ионита.
Этими методами
удается извлекать и утилизироватьценные
примеси:
соединения
мышьяка и фосфора,
хром,
цинк,
свинец,
медь,
ртуть и другие
металлы, а
также поверхностно-активные
и радиоактивные вещества.
Иониты разделяют
на катиониты и аниониты.
На катионитах
происходит обмен катионами,
а на анионитах
– анионами.
Этот обмен
можно представить в виде следующей
схемы. Катионит:
Me+
+ H[K]
→ Me[K]
+ H+. Анионит:
SO – 24 + 2[A]OH → [A]2SO4 + 2OH- Особенностью
ионитов является обратимый характер
ионообменных реакций.
Поэтому можно
«посаженные»
на ионит ионы
«снять»
обратной
реакцией. Для
этого катионит промывают раствором
кислоты, а
анионит –
раствором
щелочи. Таким
способом осуществляют регенерацию
ионитов. Для ионообменной
очистки сточных вод применяют фильтры
периодического и непрерывного действия.
Фильтр периодического действия
представляет собой закрытый цилиндрический
резервуар с расположенным у днища
щелевым дренажным устройством,
обеспечивающим равномерное отведение
воды по всему сечению фильтра. Высота слоя
загрузки ионита 1,5 – 2,5 м. Фильтр может
работать по параллельной и по противоточной
схеме. В первом случае и сточная вода,
и регенерирующий раствор подаются
сверху, во втором – сточная вода подается
снизу, а регенерирующий раствор –
сверху. На работу
ионообменного фильтра большое влияние
оказывает содержание взвешенных частиц
в подаваемой сточной воде. Поэтому
перед подачей в фильтр воду подвергают
механической очистке. Разновидностью
ионообменного метода очистки сточных
вод является электродиализ – это метод
разделения ионов под действием
электродвижущей силы, создаваемой в
растворе по обе стороны разделяющей
его мембраны. Процесс разделения
проводят в электродиализаторе. Под
действием постоянного электрического
тока катионы, двигаясь к катоду, проникают
через катионитовые мембраны, но
задерживаются анионитовыми, а анионы,
двигаясь в направлении анода, проходят
через анионитовые мембраны, но
задерживаются катионитовыми. В результате этого
из одного ряда камер ионы выводятся в
смежный ряд камер. Очищенная от солей
вода выпускается по одному коллектору,
а концентрированный раствор – по
другому. Электродиализаторы
применяют для удаления растворенных
в сточной воде солей. Оптимальная
концентрация солей 3 – 8 г/л. Во всех
электродиализаторах применяют электроды,
изготовленные преимущественно из
платинированного титана. Коагуляция
–
это процесс
укрупнения дисперсных частиц в результате
их взаимодействия и объединения в
агрегаты. В
очистке сточных вод коагуляцию применяют
для ускорения процесса осаждения
тонкодисперсных примесей и эмульгированных
веществ. Она
наиболее эффективна для удаления из
воды коллоидно-дисперсных
частиц, т.е.
частиц размером
1-100 мкм.
В процессах
очистки сточных вод коагуляция происходит
под влиянием добавляемых к ним специальных
веществ –
коагулянтов.
Коагулянты в
воде образуют хлопья гидроксидов
металлов,
которые быстро
оседают под действием силы тяжести.
Хлопья обладают
способностью улавливать коллоидные и
взвешенные частицы и агрегировать их.
Т.к.
коллоидная
частица имеет слабый отрицательный
заряд, а
хлопья коагулянтов –
слабый
положительный заряд,
то между ними
возникает взаимное притяжение.
В качестве
коагулянтов обычно используют соли
алюминия,
железа или их
смесь. Выбор
коагулянта зависит от его состава,
физико-химических
свойств,
концентрации
примесей в воде и от рН солевого состава
воды. В
качестве коагулянтов используют сульфат
алюминия,
гидрохлорид
алюминия. Из
солей железа в качестве коагулянта
используются сульфат железа и хлорид
железа, а
иногда их смеси. Флокуляция
–
это процесс
агрегации взвешенных частиц при
добавлении в сточную воду высокомолекулярных
соединений –
флокулянтов.
В отличие от
коагулянтов,
при флокуляции
агрегация происходит не только при
непосредственном контакте частиц,
но и в результате
взаимодействия молекул,
адсорбированных
на частицах коагулянта.
Флокуляцию
проводят для интенсификации процесса
образования хлопьев гидроксидов
алюминия и железа с целью повышения
скорости их осаждения.
Использование
флокулянтов позволяет снизить дозы
коагулянтов,
уменьшить
продолжительность процесса коагуляции
и повысить скорость осаждения
образовавшихся хлопьев.
Для очистки
сточных вод используют как природные,
так и
синтетические флокулянты.
К природным
относятся крахмал,
эфиры,
целлюлоза и
др. Наиболее
активным флокулянтом является диоксид
кремния. Из
синтетических органических флокулянтов
наибольшее применение в нашей стране
получил полиакриламид.
Механизм
действия флокулянтов основан на
следующих явлениях: адсорбция молекул
флокулянта на поверхности коллоидных
частиц, образование сетчатой структуры
молекул флокулянта, слипание коллоидных
частиц за счёт сил Ван-дер-Ваальса. При
действии флокулянтов между коллоидными
частицами образуются трёхмерные
структуры, способные к более быстрому
и полному отделению от жидкой фазы.
Причиной возникновения таких структур
является адсорбция макромолекул
флокулянта на нескольких частицах с
образованием между ними полимерных
мостиков. Коллоидные частицы заряжены
отрицательно, что способствует процессу
взаимной коагуляции с гидроксидом
алюминия или железа. Адсорбция
–
процесс
избирательного поглощения одного или
нескольких компонентов из газовой или
жидкой смеси поверхностью твердого
поглотителя.
Газовую или
жидкую фазу,
в которой
находится компонент,
подлежащий
удалению,
называют
носителем (газ-носитель
или жидкость-
носитель).
Поглощаемое
вещество –
адсорбтивом,
поглощенное
вещество –
адсорбатом,
а твердое тело
(поглотитель)
– адсорбентом. Адсорбционные
методы широко применяют для глубокой
очистки сточных вод от растворенных
органических веществ после биохимической
очистки, а также в локальных установках,
если концентрация этих веществ в воде
невелика и они биологически не разлагаются
или являются сильно токсичными.
Применение локальных установок
целесообразно, если вещество хорошо
адсорбируется при небольшом удельном
расходе адсорбента. Адсорбцию используют
для обезвреживания сточных вод от
фенолов, гербицидов, пестицидов,
ароматических нитросоединений, ПАВ,
красителей и т.д. Достоинством
метода является высокая эффективность,
возможность очистки сточных вод,
содержащих несколько веществ, а также
рекуперация этих веществ. Абсорбцией называют
процесс поглощения газов или паров из
газовых или парогазовых смесей жидкими
поглотителями. Этот процесс является
избирательным и обратимым. В абсорбционных
процессах участвуют две фазы – газовая
и жидкая
.
Газовая
фаза состоит из непоглощаемого газа -
носителя и одного или нескольких
абсорбируемых компонентов. Жидкая фаза
представляет собой раствор абсорбируемого
(целевого) компонента в жидком поглотителе.
При физической абсорбции газ – носитель
и жидкий поглотитель инертны по отношению
к переходящему компоненту и один по
отношению друг к другу. Для очистки
отходящих газов от диоксида серы
предложено много методов, однако на
практике нашли применение только
некоторые из них. Это связано с тем, что
объемы отходящих газов велики, а
концентрация в них SO2 мала, газы
характеризуются высокой температурой
и значительным содержанием пыли. Для
абсорбции могут быть использованы
вода, водные растворы и суспензии солей
щелочных и щелочноземельных металлов. В зависимости от
особенностей взаимодействия поглотителя
и извлекаемого из газовой смеси
компонента абсорбционные методы
подразделяются на методы, базирующиеся
на закономерностях физической абсорбции,
и методы абсорбции, сопровождаемой
химической реакцией в жидкой фазе
(хемосорбция). При
физической
абсорбции
растворение
газа не сопровождается химической
реакцией
(или, по крайней мере, эта реакция не
оказывает заметного влияния на процесс).
В данном случае над раствором существует
более или менее значительное равновесное
давление компонента и поглощение
последнего происходит
лишь до тех пор, пока его парциальное
давление в газовой фазе выше равновесного
давления над раствором. Полное извлечение
компонента из газа при этом
возможно только при противотоке и
подаче в абсорбер чистого поглотителя,
не
содержащего компонента. При физической
абсорбции энергия взаимодействия
молекул газа и абсорбента в растворе
не превышает 20 кДж/моль. При
хемосорбции
(абсорбция,
сопровождаемая химической реакцией)
абсорбируемый
компонент связывается в жидкой фазе в
виде химического соединения.
При необратимой реакции равновесное
давление компонента над раствором
ничтожно мало и возможно полное его
поглощение. При обратимой реакции
над раствором существует заметное
давление компонента, хотя и меньшее,
чем при физической абсорбции. Молекулы
растворенного газа реагируют с активным
компонентом абсорбента-хемосорбентом
(энергия взаимодействия молекул более
25 кДж/моль) либо в растворе происходит
диссоциация или ассоциация молекул
газа. Промежуточные варианты абсорбции
характеризуются энергией взаимодействия
молекул 20-30 кДж/моль. К таким процессам
относится растворение с образованием
водородной связи, в частности абсорбция
ацетилена диметилформамидом. Жидкостную
экстракцию применяют для очистки
сточных вод, содержащих фенолы, масла,
органические кислоты, ионы металлов и
др. Целесообразность
использования экстракции для очистки
сточных вод определяется концентрацией
органических примесей в них. Очистка сточных
вод экстракцией состоит из трех стадий. 1стадия
–
интенсивное смешение сточной воды с
экстрагентом (органическим растворителем).
В условиях развитой поверхности контакта
между жидкостями образуются две жидкие
фазы. Одна фаза – экстракт содержит
извлекаемое вещество и экстрагент,
другая – рафинат – сточную воду и
экстрагент. 2 с
–
разделение экстракта и рафината;
3-
регенерация
экстрагента из экстракта и рафината. Чтобы снизить
содержание растворенных примесей до
концентраций, ниже предельно допустимых,
необходимо правильно выбрать экстрагент
и скорость его подачи в сточную воду.
При выборе растворителя следует
учитывать его селективность, физ-хим
свойства, стоимость и возможные способы
регенерации. Необходимость
извлечения экстрагента из экстракта
связана с тем, что его надо вновь вернуть
в процесс экстракции. Регенерация может
быть проведена с применением вторичной
экстракции с другим растворителем, а
также выпариванием, дистилляцией,
химическим взаимодействием или
осаждением. Не проводить регенерацию
экстрагента в случае, если нет
необходимости возвращать его в цикл. Для очистки сточных
вод от различных растворимых и
диспергированных примесей применяют
процессы анодного окисления и катодного
восстановления, электрокоагуляции,
электрофлокуляции и электродиализа.
Все эти процессы протекают на электродах
при пропускании через сточную воду
постоянного электрического тока.
Электрохимические методы позволяют
извлекать из сточных вод ценные продукты
при относительно простой автоматизированной
технологической схеме очистки, без
использования химических реагентов.
Основным недостатком этих методов
является большой расход электроэнергии. Очистку сточных
вод электрохимическими методами можно
проводить периодически или непрерывно. Электрокоагуляция.
При прохождении
сточной воды через межэлектродное
пространство электролизера происходит
электролиз поды,
поляризация
частиц,
электрофорез,
окислительно-восстановительные
процессы,
взаимодействие
продуктов электролиза друг с другом.
При использовании
нерастворимых электродов коагуляция
может происходить в результате
электрофоретических явлений и разряда
заряженных частиц на электродах,
образования
в растворе веществ (хлор,
кислород),
разрушающих
сольватные соли па поверхности частиц.
Такой процесс
можно использовать для очистки вод при
невысоком содержании коллоидных частиц
и низкой устойчивости загрязнений.
Для очистки
промышленных сточных вод,
содержащих
высоко устойчивые загрязнения,
проводят
электролиз с использованием растворимых
стальных или алюминиевых анодов.
Под действием
тока происходит растворение металла,
в результате
чего в воду переходят катионы железа
или алюминия,
которые,
встречаясь с
гидроксидными группами,
образуют
гидроксиды металлов в виде хлопьев.
Наступает
интенсивная коагуляция. Достоинства метода
электрокоагуляции: компактность
установок и простота управления,
отсутствие потребности в реагентах,
малая чувствительность к изменениям
условий проведения процесса очистки
(температура, рН среды, присутствие
токсичных веществ), получение шлама с
хорошими структурно-механическими
свойствами. Недостатком метода является
повышенный расход металла и электроэнергии.
Электрокоагуляция находит применение
в пищевой, химической и целлюлозно-бумажной
промышленности. Электрофлотация.
В этом
процессе очистка сточных вод от
взвешенных частиц происходит при помощи
пузырьков газа,
образующихся
при электролизе воды.
На аноде
возникают пузырьки кислорода,
а на катоде –
водорода.
Поднимаясь в
сточной воде,
эти пузырьки
флотируют взвешенные частицы.
При использовании
растворимых электродов происходит
образование хлопьев коагулянтов и
пузырьков газа,
что способствует
более эффективной флотации. Электродиализ
– это метод разделения ионов под
действием электродвижущей силы,
создаваемой в растворе по обе стороны
разделяющей его мембраны. Процесс
разделения проводят в электродиализаторе.
Под действием постоянного электрического
тока катионы, двигаясь к катоду, проникают
через катионитовые мембраны, но
задерживаются анионитовыми, а анионы,
двигаясь в направлении анода, проходят
через анионитовые мембраны, но
задерживаются катионитовыми. В результате
этого из одного ряда камер ионы выводятся
в смежный ряд камер. Обратным осмосом
и ультрафильтрацией называют процессы
фильтрования растворов через
полупроницаемые мембраны под давлением,
превышающим осмотическое давление.
Мембраны пропускают молекулы растворителя,
задерживая растворенные вещества. При
обратном осмосе отделяются частицы
(молекулы, гидратированные ионы), размеры
которых не превышают размеров молекул
растворителя. При ультрафильтрации
размер отдельных частиц d
ч
на порядок больше. Обратный осмос,
схема которого приведена на широко
используется для обессоливания воды
в системах водоподготовки ТЭЦ и
предприятий различных отраслей
промышленности (полупроводников,
кинескопов, медикаментов и др.); в
последние годы начинает применяться
для очистки некоторых промышленных и
городских сточных вод. Простейшая
установка обратного осмоса состоит из
насоса высокого давления и модуля
(мембранного элемента), соединенных
последовательно. Эффективность
процесса зависит от свойств применяемых
мембран. Они должны обладать следующими
достоинствами: высокой разделяющей
способностью (селективностью), большой
удельной производительностью
(проницаемостью), устойчивостью к
действию среды, неизменностью
характеристик в процессе эксплуатации,
достаточной механической прочностью,
низкой стоимостью. Для ультрафильтрации
предложен другой механизм разделения.
Растворенные вещества задерживаются
на мембране потому, что размер молекул
их больше, чем размер пор, или вследствие
трения молекул о стенки пор мембраны.
В действительности в процессе обратного
осмоса и ультрафильтрации имеют место
более сложные явления. Процесс мембранного
разделения зависит от давления,
гидродинамических условий и конструкции
аппарата, природы и концентрации сточных
вод, содержания в них примесей, а также
от температуры. Увеличение концентрации
раствора приводит к росту осмотического
давления растворителя, повышению
вязкости раствора и росту концентрационной
поляризации, то есть к снижению
проницаемости и селективности. Природа
растворенного вещества оказывает
влияние на селективность. При одинаковой
молекулярной массе неорганические
вещества задерживаются на мембране
лучше, чем органические. Для того чтобы
концентрация вредного вещества в
приземном слое атмосферы не превышала
предельно допустимую максимальную
разовую концентрацию, пылегазовые
выбросы подвергаются рассеиванию в
атмосфере через высотные трубы.
Распространение в атмосфере выбрасываемых
из труб промышленных выбросов подчиняется
законам турбулентной диффузии. На
процесс рассеивания выбросов существенное
влияние оказывают состояние атмосферы,
расположение предприятий, характер
местности, физические свойства выбросов,
высота трубы, диаметр устья и др.
Горизонтальное перемещение примесей
определяется в основном скоростью
ветра, а вертикальное - распределением
температур в вертикальном направлении. По мере удаления
от трубы в направлении распространения
промышленных выбросов концентрация
вредностей в приземном слое атмосферы
сначала нарастает, достигает максимума
и затем медленно убывает, что позволяет
говорить о наличии трех зон неодинакового
загрязнения атмосферы: зона переброса
факела выбросов, характеризующаяся
относительно невысоким содержанием
вредных веществ в приземном слое
атмосферы; зона задымления - зона
максимального содержания вредных
веществ и зона постепенного снижения
уровня загрязнения. Согласно
действующей методике минимальная
высота Н min
одноствольной трубы для рассеивания
газовоздушных выбросов, имеющих
температуру выше температуры окружающего
воздуха, определяется по формуле H min =√AMk F mn/ПДК
3 √1/QΔT, где
А - коэффициент, зависящий от температурного
градиента атмосферы и определяющий
условия вертикального и горизонтального
рассеивания вредностей. В зависимости
от метеорологических условий для
субтропической зоны Средней Азии A=240;
для Казахстана, Нижнего Поволжья,
Кавказа, Молдавии, Сибири, Дальнего
Востока и остальных районов Средней
Азии - 200; Севера и Северо-Запада
европейской территории СССР, Среднего
Поволжья, Урала и Украины - 160; Центральной
части европейской территории СССР -
120; М
- количество вредного вещества,
выбрасываемого в атмосферу, г/с; Q
- объемный расход газовоздушной смеси,
выбрасываемой из всех труб, м 3 /с; k F
- коэффициент, учитывающий скорость
оседания взвешенных частиц выброса в
атмосфере. Для газов k F =1,
для пыли при эффективности очистки
газоочистной установки более 0,90-2,5 и
менее 0,75-3; ΔT
- разность температур выбрасываемой
газовоздушной смеси и окружающего
атмосферного воздуха. Температуру
окружающего воздуха принимают по
средней температуре самого жаркого
месяца в 13 часов; m
и п - безразмерные коэффициенты,
учитывающие условия выхода газовоздушной
смеси из устья источника выброса.![]() )
)![]() . (4.4)
. (4.4) , (4.5)
, (4.5) , (4.6)
, (4.6) . (4.7)
. (4.7) , (4.8)
, (4.8) . (4.9)
. (4.9) , отсюда (4.10)
, отсюда (4.10) . (4.11)
. (4.11)
 ).
). ,
, , (4.13)
, (4.13) , (4.14)
, (4.14)![]() (4.15)
(4.15)![]() ; ; при .
; ; при .![]() ; при .
; при .






![]()
![]()
 ри
седиментационном анализе дисперсности
полидисперсных систем определяют время
осаждения частиц отдельных фракций,
рассчитывают скорости их осаждения и
соответствующие им размеры частиц. Для
этого сначала измеряют зависимость
массы осевшего осадка от времени, строят
график этой зависимости, называемой
кривой седиментации, по которому затем
определяют все необходимые характеристики
дисперсной системы.
ри
седиментационном анализе дисперсности
полидисперсных систем определяют время
осаждения частиц отдельных фракций,
рассчитывают скорости их осаждения и
соответствующие им размеры частиц. Для
этого сначала измеряют зависимость
массы осевшего осадка от времени, строят
график этой зависимости, называемой
кривой седиментации, по которому затем
определяют все необходимые характеристики
дисперсной системы. еальная
кривая седиментации полидисперсной
системы обычно получается плавной и ей
отвечает множество бесконечно малых
участков, касательные в каждой точке
этой кривой отражают седиментацию
данной бесконечно малой фракции.
еальная
кривая седиментации полидисперсной
системы обычно получается плавной и ей
отвечает множество бесконечно малых
участков, касательные в каждой точке
этой кривой отражают седиментацию
данной бесконечно малой фракции.
![]()
![]()
 йнштейн
и Смолуховский для количественного
выражения броуновского движения частиц
ввели представление о среднем сдвиге
частицы. Если при наблюдении движения
частицы золя под микроскопом через
определенные равные промежутки времени
отмечать ее местонахождение, то можно
получить ее траекторию движения. Так
как движение происходит в трехмерном
пространстве, то квадрат среднего
расстояния, проходимого частицей за
любой промежуток времени, равен
йнштейн
и Смолуховский для количественного
выражения броуновского движения частиц
ввели представление о среднем сдвиге
частицы. Если при наблюдении движения
частицы золя под микроскопом через
определенные равные промежутки времени
отмечать ее местонахождение, то можно
получить ее траекторию движения. Так
как движение происходит в трехмерном
пространстве, то квадрат среднего
расстояния, проходимого частицей за
любой промежуток времени, равен![]() .
.![]() .
.![]()
 ля
установления связи между средним сдвигом
(смещением) частицы и коэффициентом
диффузии представим себе трубку с
поперечным сечениемS,
наполненную золем, концентрация частиц
которого уменьшается слева направо. В
этом же направлении протекает и диффузия
частиц золя (на рисуике отмечено
стрелкой). Выделим по обе стороны от
линии MN
два малых участка 1 и 2, размеры которых
в направлении диффузии равны Δ
- среднему квадратичному сдвигу за
время τ. Обозначим частичную концентрацию
золя в объемах этих участков соответственно
через ν 1
и ν 2
(ν 1 >ν 2).
Хаотичность теплового движения приводит
к равной вероятности переноса дисперсной
фазы из обоих объемов вправо и влево от
линии MN:
половина частиц переместится вправо,
а другая половина - влево. Количество
дисперсной фазы за время τ
переместится из объема 1 вправо: ,а из объема 2 влево
(в обратном направлении):
ля
установления связи между средним сдвигом
(смещением) частицы и коэффициентом
диффузии представим себе трубку с
поперечным сечениемS,
наполненную золем, концентрация частиц
которого уменьшается слева направо. В
этом же направлении протекает и диффузия
частиц золя (на рисуике отмечено
стрелкой). Выделим по обе стороны от
линии MN
два малых участка 1 и 2, размеры которых
в направлении диффузии равны Δ
- среднему квадратичному сдвигу за
время τ. Обозначим частичную концентрацию
золя в объемах этих участков соответственно
через ν 1
и ν 2
(ν 1 >ν 2).
Хаотичность теплового движения приводит
к равной вероятности переноса дисперсной
фазы из обоих объемов вправо и влево от
линии MN:
половина частиц переместится вправо,
а другая половина - влево. Количество
дисперсной фазы за время τ
переместится из объема 1 вправо: ,а из объема 2 влево
(в обратном направлении):![]() .
.![]()
![]() ,окончательно
имеем:
,окончательно
имеем:
 сли
степень пересыщения меньше критической,
то возникающие зародыши самопроизвольно
испаряются (растворяются). Их размеры
меньше критического, поэтому энергия
Гиббса понижается с уменьшением размера
зародыша. Пересыщенный раствор или пар
в этих условиях иногда удобно представить
как гетерогенно-дисперсную систему, в
которой присутствует множество постоянно
образующихся и исчезающих зародышей
новой фазы. В критической точке
неустойчивость равновесия проявляется
в том, что существует равная вероятность
возникновения и исчезновения зародышей
конденсации.
сли
степень пересыщения меньше критической,
то возникающие зародыши самопроизвольно
испаряются (растворяются). Их размеры
меньше критического, поэтому энергия
Гиббса понижается с уменьшением размера
зародыша. Пересыщенный раствор или пар
в этих условиях иногда удобно представить
как гетерогенно-дисперсную систему, в
которой присутствует множество постоянно
образующихся и исчезающих зародышей
новой фазы. В критической точке
неустойчивость равновесия проявляется
в том, что существует равная вероятность
возникновения и исчезновения зародышей
конденсации.![]()
"
2. Факторы, влияющие на величину скорости осаждения частицы.
3. Процессы флотации.
4.Ионный обмен
5. Коагуляция, флокуляция. Область применения.
6.Адсорбция. Определение. Область применения
7.АБсорбция. Определение. Область применения
8.Физическая и химическая абсорбция.
9.Очистка сточных вод экстракцией.
10. Процессы электрохимического окисления и восстановления.
11.Процессы электрокоагуляции, электрофлотации, электродиализа
12.Мембранные процессы
13.Рассеивание вредных веществ в атмосфере.